Характерные химические свойства основных, амфотерных и кислотных оксидов
Оглавление
- Оксиды
- Типичные реакции основных оксидов
- Типичные реакции кислотных оксидов
- Типичные реакции амфотерных оксидов
- Получение оксидов
- Шпаргалка
- Итог урока
Оксиды
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (-2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды могут быть твердыми (песок SiO2, разновидности кварца), жидкими (оксид водорода H2O), газообразными (оксиды углерода: углекислый CO2 и угарный СО газы).
Номенклатура химических соединений развивалась по мере накопления фактического материала. Сначала, пока число известных соединений было невелико, широко использовались тривиальные названия, не отражающие состава, строения и свойства вещества, — сурик РЬ3О4, глет РЬО, жженая магнезия MgO, железная окалина Fe3О4, веселящий газ N2О, белый мышьяк As2О3• На смену тривиальной номенклатуре при шла полусистематическая номенклатура — в название были включены указания числа атомов кислорода в соединении: закись — для более низких, окись — для более высоких степеней окисления; ангидрид — для оксидов кислотного характера.
В настоящее время почти завершен переход к современной номенклатуре. Согласно международной номенклатуре, в названии оксида следует указывать валентность элемента; например, SО2 — оксид cepы(IV), SО3 — оксид cepы(VI), CrO — оксид хрома(II), Cr2О3 — оксид хрома(III), CrO3 — оксид хрома(VI).
По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
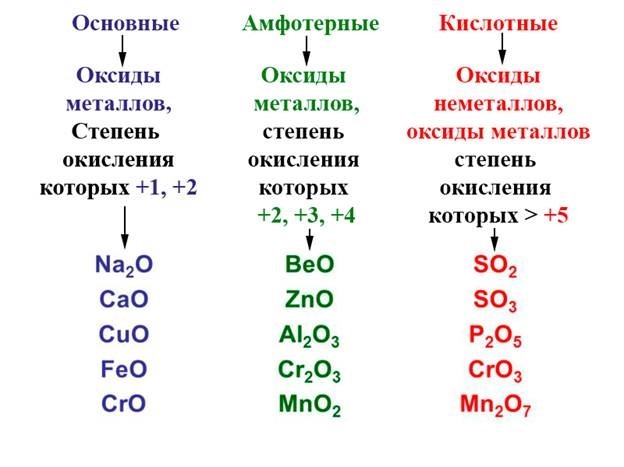
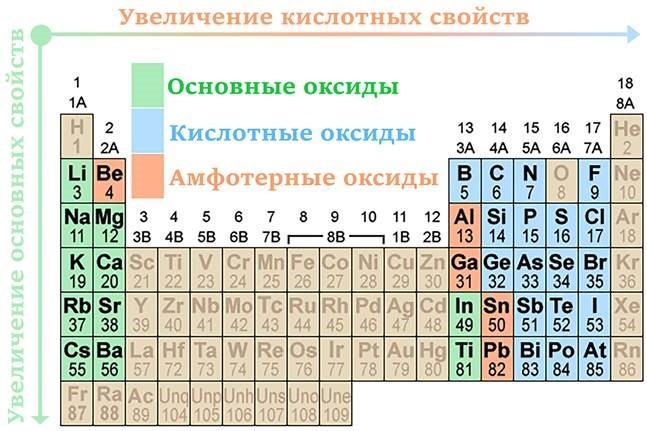
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Основные оксиды — это такие оксиды, которым соответствуют основания. Например: CuO соответствует основание Cu(OH)2, Na2O — основание NaOH, Cu2O — CuOH и т. д.
Типичные реакции основных оксидов
1. Основный оксид + кислота = соль + вода (реакция обмена):
2. Основный оксид + кислотный оксид = соль (реакция соединения):
3. Основный оксид + вода = щелочь (реакция соединения):
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов: N2O5 соответствует HNO3, SO3 — H2SO4, CO2 — H2CO3, P2O5 — H4PO4 а также оксиды металлов с большим значением степеней окисления: Cr2+6O3 соответствует H2CrO4, Mn2+7O7 — HMnO4.
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание = соль + вода (реакция обмена):
2. Кислотный оксид + основный оксид соль (реакция соединения):
3. Кислотный оксид + вода = кислота (реакция соединения):
Такая реакция возможна, только если кислотный оксид растворим в воде.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Это ZnO, Al2O3, Cr2O3, V2O5.
Амфотерные оксиды с водой непосредственно не соединяются.
Типичные реакции амфотерных оксидов
1. Амфотерный оксид + кислота = соль + вода (реакция обмена):
2. Амфотерный оксид + основание = соль + вода или комплексное соединение:

 Получение оксидов
Получение оксидов
Основные оксиды. К основным относят оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов
Окисление металлов при нагревании в атмосфере кислорода.
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
Метод неприменим для получения оксидов щелочных металлов. В реакции с кислородом щелочные металлы обычно дают пероксиды, поэтому оксиды Na2O, К2O труднодоступны.
Обжиг сульфидов
2CuS + 3O2 = 2CuO + 2SO2
4FeS2 + 1102 = 2Fe2O3 + 8SO2
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
Разложение гидроксидов
Cu(OH)2 = СuО + Н2О
Этим методом нельзя получить оксиды щелочных металлов.
Разложение солей кислородсодержащих кислот.
ВаСO3 = ВаО + СO2
2Pb(NO3)2 = 2РЬО + 4N02 + O2
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Разложение легко осуществляется для нитратов и карбонатов, в том числе и для основных солей.
[ZnОH]2CO3 = 2ZnO + СO2 + Н2O
Получение кислотных оксидов
Кислотные оксиды представлены оксидами неметаллов или переходных металлов в высоких степенях окисления. Они могут быть получены методами, аналогичными методам получения основных оксидов, например:
- 4Р + 5O2 = 2Р2O5
- 2ZnS + 3O2 = 2ZnO + 2SO2
- K2Cr2O7 + H2SO4 = 2CrO3↓ + K2SO4 + H2O
- Na2SiO3 + 2HCl = 2NaCl + SiO2↓ + H2O

Шпаргалка
Справочный материал для прохождения тестирования:






























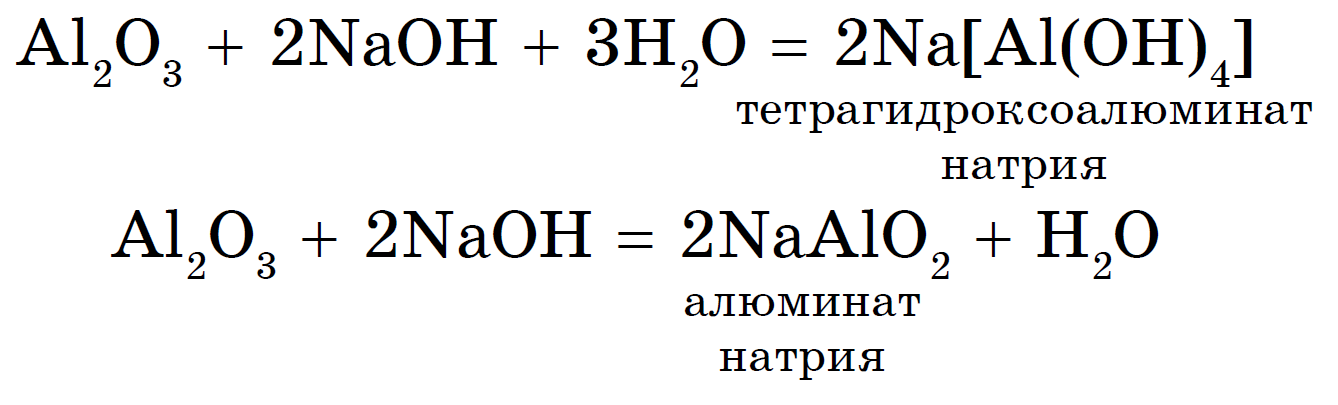









Химией увлекаюсь с детства и люблю такую информацию, спасибо, очень информативно)))).
Как по мне, то информация изложена кратко, емко и вполне понятно. Отдельное спасибо за шпаргалку, может быть, воспользуюсь на всякий случай))