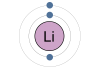
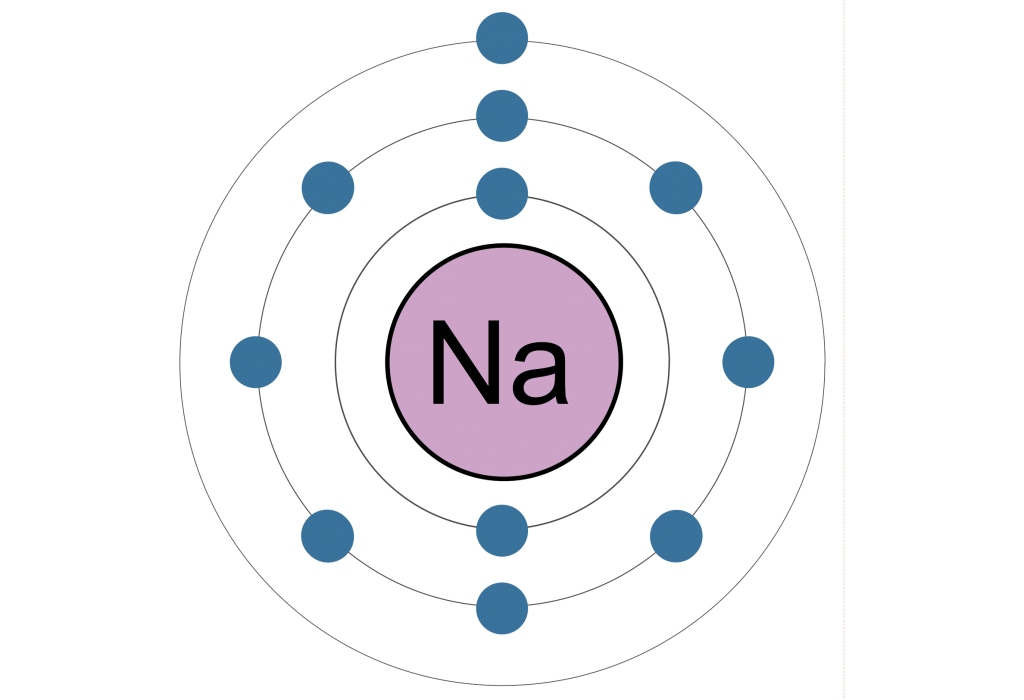
НАТРИЙ
«Получение металлического натрия относится к важнейшим открытиям в химии не потому одному, что чрез то расширилось и стало более правильным понятие о простых телах, но потому особенно, что в натрии видны химические свойства, лишь слабо выраженные в других общеизвестных металлах.»
Д. И. Менделеев. Основы химии.
Русское название «натрий» (оно есть также в шведском и немецком языках) происходит от слова «натрон»: так древние египтяне называли сухую соду, которую использовали в процессе мумификации. В XVIII веке название «натрон» закрепилось за «минеральной щелочью» — едким натром. Сейчас натронной известью называют смесь едкого натра и оксида кальция (по-английски soda lime), а натрий по-английски (и во многих других языках — sodium). Слово «сода» произошло от латинского названия растения солянка (sodanum). Это прибрежное морское растение, золу которого в древности использовали при изготовлении стекла. В этой золе содержится карбонат натрия, который назвали содой. И сейчас сода — важнейшая составная часть шихты для производства большинства стекол, в том числе оконных.
Первым из людей, который увидел, как выглядит металлический натрий, был Г. Дэви, выделивший новый металл с помощью электролиза. Он же предложил название новому элементу — sodium.
Натрий — очень активный металл, он быстро окисляется на воздухе, покрываясь толстой коркой продуктов реакций с кислородом и водяными парами. Известен лекционный опыт: если маленький кусочек натрия бросить в воду, он начнет реагировать с ней, выделяя водород. В реакции выделяется много теплоты, которая расплавляет натрий, и его шарик бегает по поверхности. Вода охлаждает натрий и не дает водороду вспыхнуть, но если кусок натрия будет большим, возможно возгорание и даже взрыв.

Металлический натрий широко применяется для различных синтезов как восстановитель, а также как осушитель неводных жидкостей. Он присутствует в обладающих высокой емкостью натриево-серных аккумуляторах. Легкоплавкий сплав натрия с калием, жидкий при комнатной температуре, работает теплоносителем, отводящим избыточную тепловую энергию от ядерных реакторов. Всем известен желтый цвет пламени в присутствии натрия: именно так окрашивается пламя газовой конфорки, если в него попадет мельчайшая капля соленого супа. Пары натрия светятся желтым светом в экономичных газоразрядных лампах, освещающих улицы.
Многие столетия соль была единственным средством консервации пищевых продуктов. Без поваренной соли были бы невозможны дальние морские плавания, кругосветные экспедиции и великие географические открытия. История России знает грандиозное восстание, получившее название Соляной бунт, которое началось в 1648 г. и прокатилось по всей стране. Одна из причин восстания — повышение на-лога на соль.
Когда-то натрий получали сотнями тысяч тонн в год: его использовали для получения тетраэтилсвинца, повышающего октановое число бензина. Запрет на этилированный бензин во многих странах привел к снижению производства натрия. Сейчас мировое производство натрия — около 100 тысяч тонн в год.
Минерал галит (хлорид натрия) образует громадные залежи каменной соли. Толь-ко в России ее запасы исчисляются десятками миллиардов тонн. Галит обычно содержит до 8% других солей, в основном магния и кальция. Ежегодно добывается более 280 млн тонн хлорида натрия, это одно из самых крупномасштабных производств. Когда-то в больших количествах добывали в Чили нитрат натрия, отсюда его название — чилийская селитра.
Применение находят и другие соли натрия, которых в настоящее время известно множество. Одна из самых известных — сульфат натрия. Если эта соль содержит воду, она называется глауберовой. Огромные ее количества образуются при испарении воды в заливе Кара-Богаз-Гол Каспийского моря (Туркмения), а также в некоторых соляных озерах. В настоящее время растворы сульфата натрия используются в качестве аккумулятора тепла в устройствах, сохраняющих солнечную энергию, в производстве стекла, бумаги, тканей.
Натрий — жизненно важный элемент. Ионы натрия находятся в основном во внеклеточной жидкости и участвуют в механизме мышечных сокращений (недостаток натрия вызывает судороги), в поддержании водно-солевого (ионы натрия задерживают воду в организме) и кислотно-щелочного баланса (поддержание постоянного значении рН крови). Из хлорида натрия в желудке вырабатывается соляная кислота, без которой невозможно переваривание пищи. Содержание натрия в теле среднего человека — около 100 г. Натрий поступает в организм в основном в виде поваренной соли, ее суточная доза составляет 3—6 г. Одно-кратная доза более 30 г опасна для жизни.