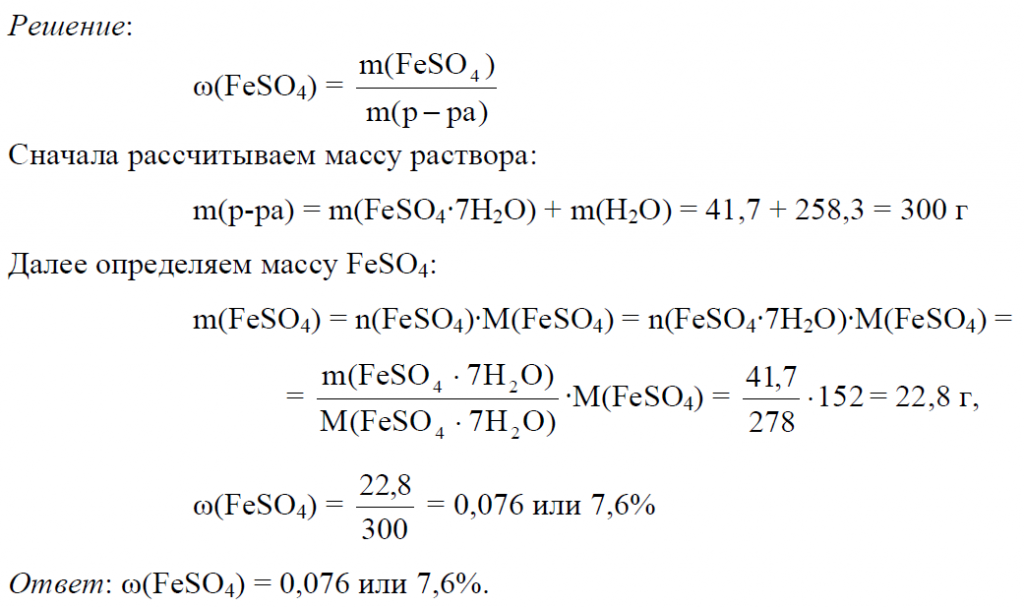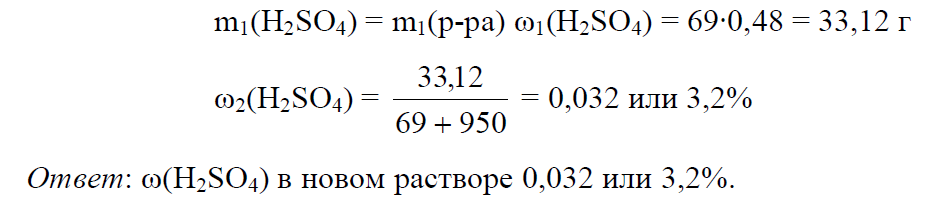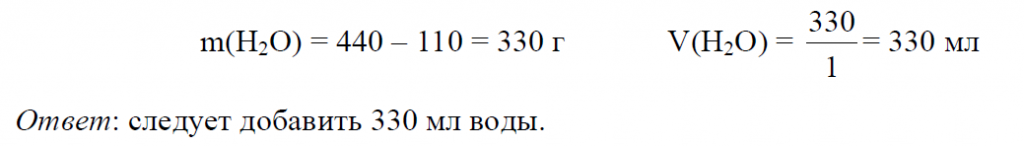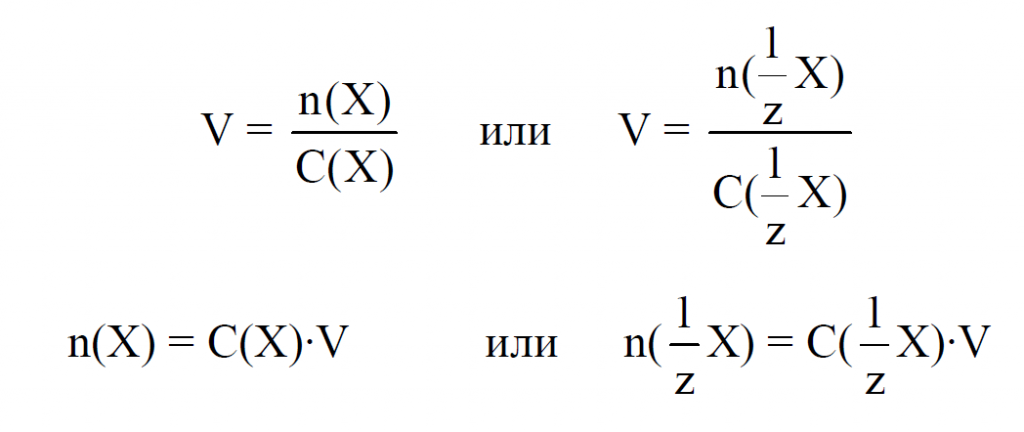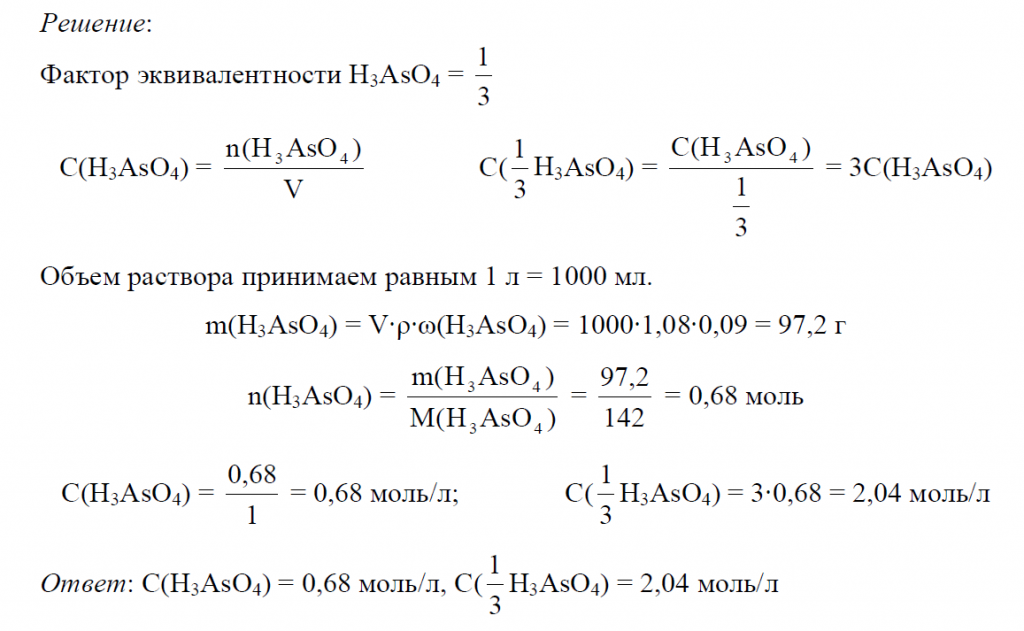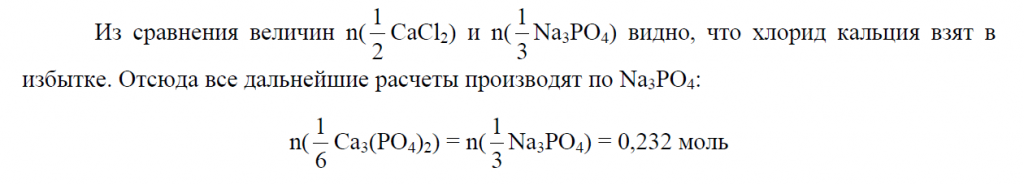Концентрация растворов
Оглавление
- Массовая доля вещества
- Расчет массовой доли растворенного вещества
- Вычисление массы растворенного вещества или растворителя по массе раствора
- Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
- Разбавление и концентрирование растворов
- Расчеты, связанные со смешиванием растворов
- Молярная концентрация
- Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации
- Расчеты, связанные с разбавлением и концентрированием растворов
- Расчеты, связанные со смешиванием растворов различной концентрации
- Расчеты материального баланса химических процессов: избыток (недостаток) реагентов
Массовая доля растворенного вещества — это отношение его массы m к массе раствора mр. Ее обозначают буквой ω («омега»).
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой φ («фи»).
Процентная концентрация раствора — это отношение массы растворенного вещества m (в граммах) к массе раствора (в граммах).
Расчет массовой доли растворенного вещества
Пример 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г. его растворено в 280 мл воды.
Пример 2. В 258,3 г. воды растворили 41,7 г. кристаллогидрата FeSO4·7H2O. Определить массовую долю FeSO4 в полученном растворе.
Пример 3. Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Пример 4. Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Вычисление массы растворенного вещества или растворителя по массе раствора
Пример 5. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Пример 6. Определите массу кристаллогидрата CuSO4·5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора с массовой долей K2SO4 10%, который можно приготовить из 200 г воды и сульфата калия.
Пример 8. При растворении в 400 г воды некоторого количества CuSO4·5H2O получен раствор с массовой долей CuSO4 5%. Рассчитать массу использованного кристаллогидрата и массу полученного раствора.
Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением и концентрированием растворов, следует помнить, что масса растворенного вещества остается неизменной, т.е. m(Х) = const. Изменяется только масса растворителя и, соответственно, масса раствора.
Пример 9. К 50 мл раствора H2SO4 (ω1 = 48%, ρ = 1,38 г/мл) добавили 950 мл воды. Определить массовую долю H2SO4 в полученном растворе.
Пример 10. Какой объем воды необходимо добавить к 100 мл раствора азотной кислоты (ρ = 1,1 г/мл, ω1 = 20%), чтобы получить раствор HNO3 с ω2 = 5%?
Пример 11. Из 200 мл раствора сульфата меди (ρ = 1,1 г/мл, ω1 = 8%) выпарили 100 мл воды. Определить ω(CuSO4) в полученном растворе.
Расчеты, связанные со смешиванием растворов
При смешивании масса полученного раствора (m) равняется сумме масс смешиваемых растворов (m1, m2, m3 … mn):
m = m1 + m2 + m3 +…+ mn, г
Аналогично, масса растворенного вещества будет равна сумме масс веществ в смешиваемых растворах:
m(X) = m1(X) + m2(X) + m3(X) +…+ mn(X), г
Пример 12. Определить массовую долю HNO3 в растворе, полученном при смешивании 100 мл раствора с ω1(HNO3) = 10% (ρ1 = 1,05 г/мл) и 150 мл раствора с ω2(HNO3) = 20% (ρ2 = 1,12 г/мл).
Пример 13. Какие объемы растворов гидроксида калия с ω1(KOH) = 50% (ρ1 = 1,51 г/мл) и с ω2(KOH) = 10% (ρ2 = 1,1 г/мл) необходимо использовать для приготовления одного литра раствора гидроксида калия с ω(KOH) = 20% (ρ = 1,19 г/мл)?
Молярная концентрация
Молярная концентрация (молярность) – это количество моль вещества, содержащееся в 1 литре раствора.
где Х – количество вещества, моль; V – объем раствора, л.
Объем раствора связан с массой раствора следующим образом:
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента – это количество моль вещества эквивалента, содержащееся в 1 литре раствора.
где n(1/z*X) – количество вещества эквивалента, моль;
V – объем раствора, л.
где M(X) – молярная масса растворенного вещества;
m(X) – масса растворенного вещества; –m масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента всегда больше или равна молярной концентрации. Это положение используется при проверке полученных данных.
Молярную концентрацию эквивалента часто называют нормальной и обозначают 1,0 н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы позволяют определять объем раствора, количество вещества и количество вещества эквивалента:
Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации
Пример 1. Рассчитать молярную концентрацию и молярную концентрацию эквивалента K2CrO4, если в 0,55 л раствора растворено 14,7 г вещества (реакции обменные).
Пример 2. Определить массу вещества, содержащегося в 200 мл раствора нитрата никеля с молярной концентрацией С(Ni(NO3)2) = 0,125 моль/л.
Пример 3. Рассчитать молярную концентрацию эквивалента в растворе HCl. ω(HCl) = 25%, ρ = 1,15 г/мл.
Пример 4. В 0,6 л воды растворили 100 л бромоводорода. Рассчитать С(HBr) в растворе, если ρ = 1,15 г/мл.
Пример 5. Рассчитать молярную и молярную концентрацию эквивалента раствора мышьяковой кислоты (H3AsO4). Плотность раствора 1,08 г/мл, массовая доля H3AsO4 9%.
Расчеты, связанные с разбавлением и концентрированием растворов
При разбавлении и концентрировании растворов количество вещества (количества вещества эквивалента) остается постоянным.
Пример 6. Какой объем раствора HCl, С1(HCl) = 6 моль/л, необходимо использовать для приготовления 250 мл раствора этой кислоты с концентрацией С2(HCl) = 2,5 моль/л.
Пример 7. До какого объема следует упарить 3,5 л раствора серной кислоты, С1(1/2H2SO4) = 0,04 моль/л, чтобы получить раствор с концентрацией кислоты 0,2 моль/л.
Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество вещества n(X) (количества вещества эквивалента) в полученном растворе равно сумме количества вещества (количества вещества эквивалента) в смешиваемых растворах n1(X), n2(X) … nn(X):
n(X) = n1(X) + n2(X) + n3(X) +…+ nn(X),
При смешивании растворов объем полученного раствора не равен сумме объемов смешиваемых растворов. Это явление называют контракцией растворов. Поэтому объем полученного раствора следует рассчитывать.
При решении задач на смешивание растворов часто приходится производить перерасчет одной концентрации в другую.
Пример 8. Рассчитать массовую долю 1,25 н. раствора фосфорной кислоты, если плотность раствора составляет 1,05 г/мл.
Пример 9. Смешали 3 литра раствора H3PO4 (C(H3PO4) = 0,1 моль/л) и 2 литра раствора H3PO4 (ω(H3PO4) = 90%, ρ = 1,05 г/мл). Вычислить молярную концентрацию и молярную концентрацию эквивалента полученного раствора (контракцией можно пренебречь).
Расчеты материального баланса химических процессов: избыток (недостаток) реагентов
Пример 10. Рассчитать массу осадка, который выделится при смешивании 200 мл раствора хлорида кальция ω(CaCl2) = 10%, ρ1 = 1,08 г/мл и 150 мл раствора фосфата натрия ω(Na3PO4) = 8%, ρ2 = 1,06 г/мл.
Пример 11. Для осаждения ионов железа (II), содержащихся в 20 мл раствора FeSO4, израсходовано 30 мл раствора гидроксида калия, С(KOH) = 0,3 моль/л. Определить молярную и молярную концентрацию эквивалента раствора сульфата железа (II).
Справочный материал для прохождения тестирования: