Общие научные принципы химического производства
Оглавление
- Химическая промышленность и химическая технология
- Сырье
- Вода
- Общие способы получения металлов
- Производство аммиака и метанола
- Природные источники углеводородов. Их переработка. Нефть
- Крекинг
- Попутный нефтяной газ
- Каменный уголь
- Природный газ
- Производство серной кислоты
- Шпаргалка
- Задания для самопроверки
Химическая промышленность и химическая технология
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности. Одиннадцать первых мест по объему производства принадлежат следующим химическим веществам: H2SO4, NH3, N2, CaO, O2, C2H4, NaOH, Cl2, HCl, H3PO4, HNO3. Эти-то вещества и используются в больших количествах далее для получения столь необходимых видов продукции, названных выше.
Даже если речь идет о «100%-м природном продукте», это означает лишь то, что в нем нет синтетических добавок, и совсем не означает, что при его получении не использовали какие-либо химические технологии.
Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья. Основой ее является химическая технология — наука о наиболее экономичных методах и средствах массовой
химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
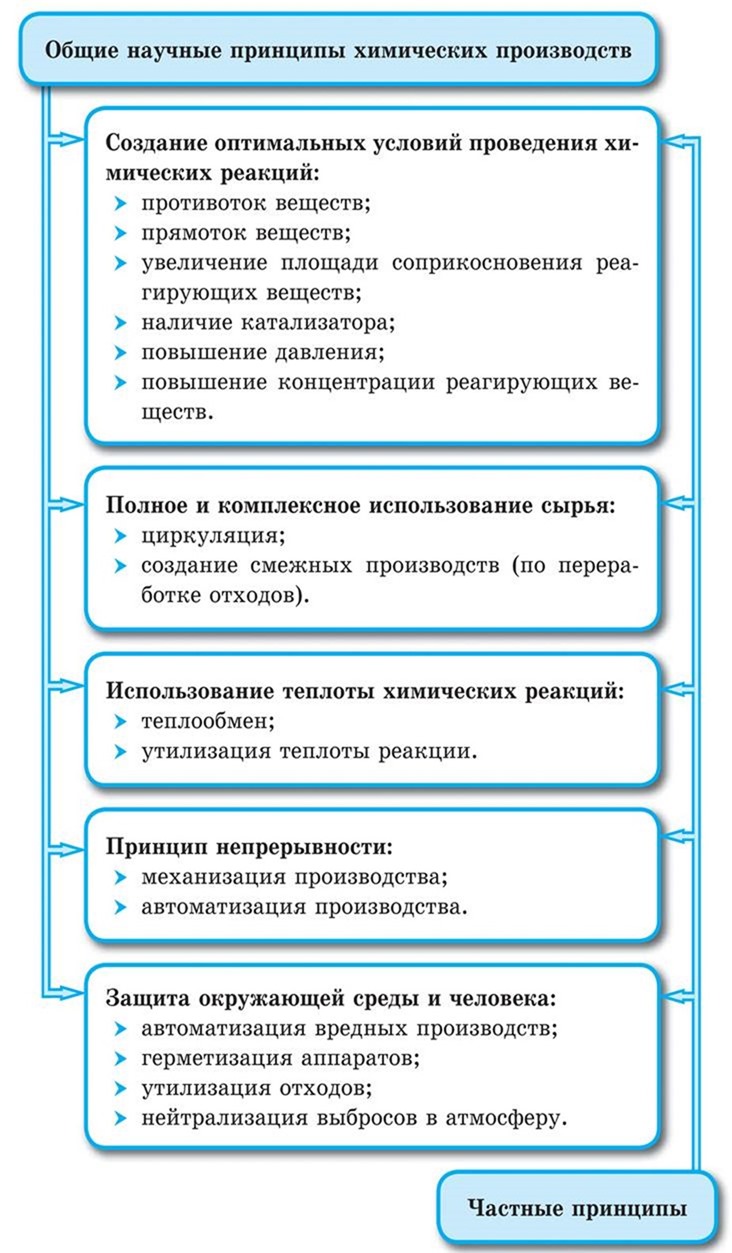
Любое химическое производство создается на основе общих научных принципов и включает составляющие:
Важнейшими составляющими химического производства являются:
• аппаратура;
• сырье;
• энергия;
• вода (и другие вспомогательные материалы).
Сырье
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленную переработку.
Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких- либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относятся все виды руд (из них получают металлы), а также нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйства. В основном оно используется для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы.
В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья.
Вода
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов.
В химической, металлургической, пищевой и легкой промышленностях воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Ag, Hg, Pt, Au, Cu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рас
смотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов:
• пирометаллургический;
• гидрометаллургический;
• электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnO2, а медь — из куприта Cu2O прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
Восстановлением углем можно получить Fe, Cu, Zn, Cd, Ge, Sn, Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
Водородотермия:
К достоинствам этого метода относится получение очень чистого металла.
Магний и алюмотермия:
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика (2Al + 1,5O2 = Al2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1 — теплота образования продукта, Q2 — теплота образования исходного вещества.
Гидрометаллургия — это восстановление металлов из их солей в растворе. Процесс проходит в два этапа:
1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла;
2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди CuO, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом получают серебро, цинк, молибден, золото, уран.
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
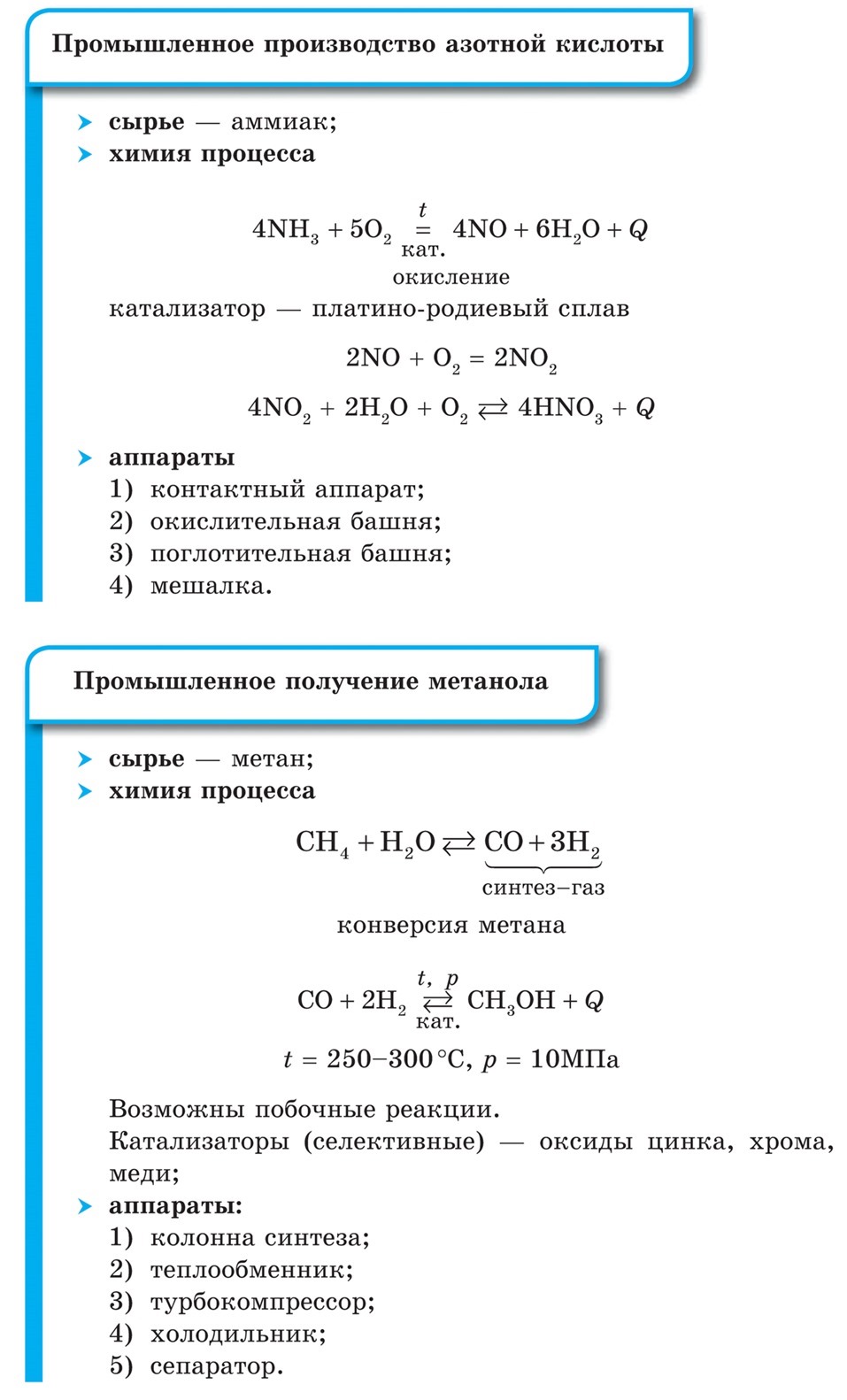
Производство аммиака и метанола
Любое химическое производство состоит из отдельных взаимосвязанных процессов (стадий).
Основные стадии химического производства:
1) подготовка сырья и подвод реагирующих веществ в зону реакции;
2) химические процессы;
3) отвод продуктов и непрореагировавших веществ из зоны реакции.
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках, которые часто монтируют на одном предприятии.
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии.
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органическое стекло) соответственно. Помимо этого, метанол применяют для синтеза некоторых красителей, фотореактивов и фармакологических препаратов, а также как растворитель, экстрагент. В ряде стран метанол ис- пользют в качестве моторного топлива, т. к. его добавление к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
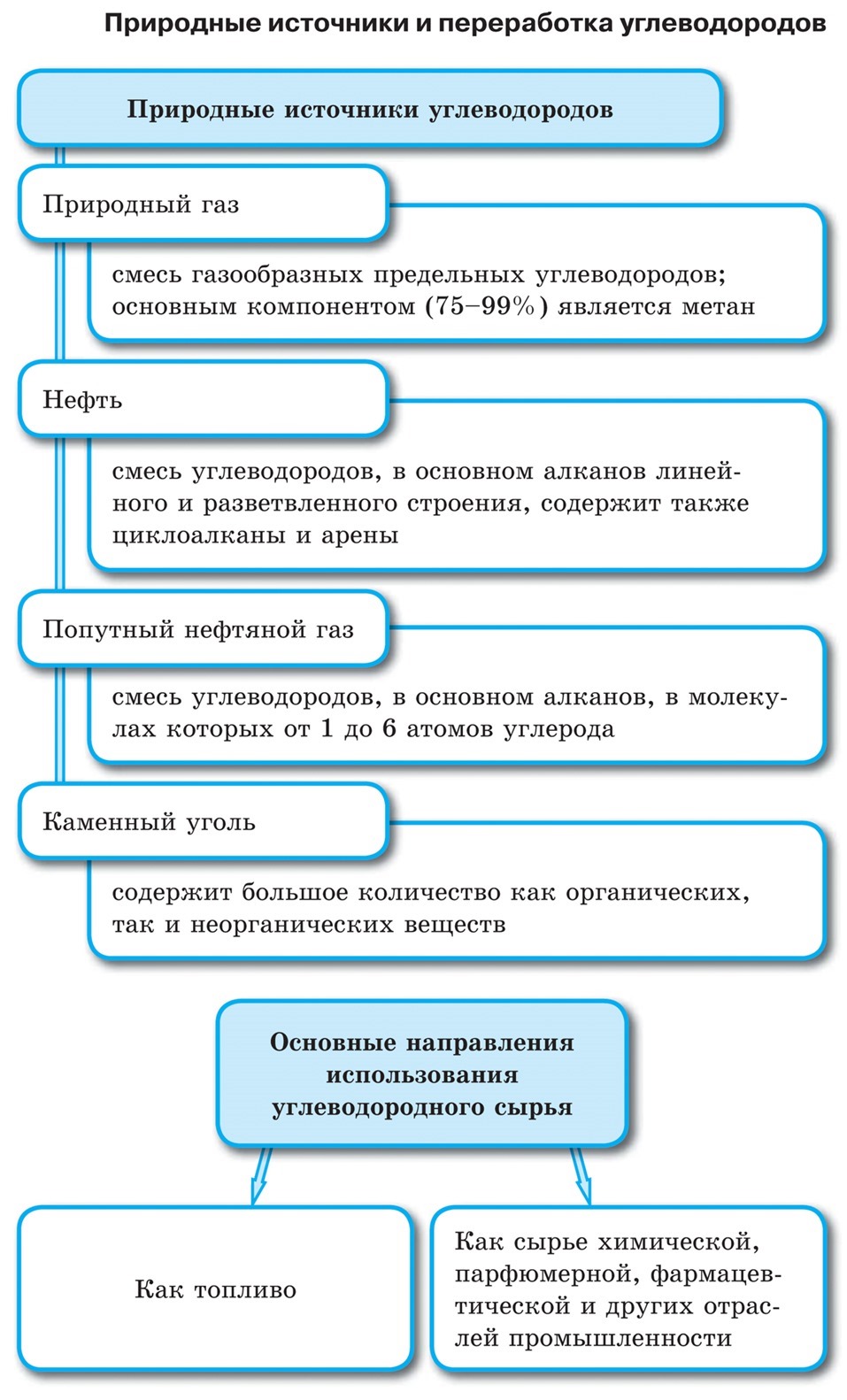
Природные источники углеводородов. Нефть.
Это природная сложная смесь углеводородов, в основном алканов линейного и разветвленного строения, содержащих в молекулах от 5 до 50 атомов углерода, с другими органическими веществами. Состав ее существенно зависит от места ее добычи (месторождения), она может помимо алканов содержать циклоалканы и ароматические углеводороды.
Газообразные и твердые компоненты нефти растворены в ее жидких составляющих, что и определяет агрегатное состояние.
Нефть — маслянистая жидкость темного (от бурого до черного) цвета с характерным запахом, нерастворимая в воде. Ее плотность меньше, чем у воды, поэтому, попадая в нее, нефть растекается по поверхности, препятствуя растворению кислорода и других газов воздуха в воде. Очевидно, что, попадая в природные водоемы, нефть вызывает гибель микроорганизмов и животных, приводя к экологическим бедствиям и даже катастрофам.
Существуют бактерии, способные использовать компоненты нефти в качестве пищи, преобразуя ее в безвредные продукты своей жизнедеятельности. Понятно, что именно использование культур этих бактерий — наиболее экологически безопасный и перспективный путь борьбы с загрязнением окружающей среды нефтью в процессе ее добычи, транспортировки и переработки.
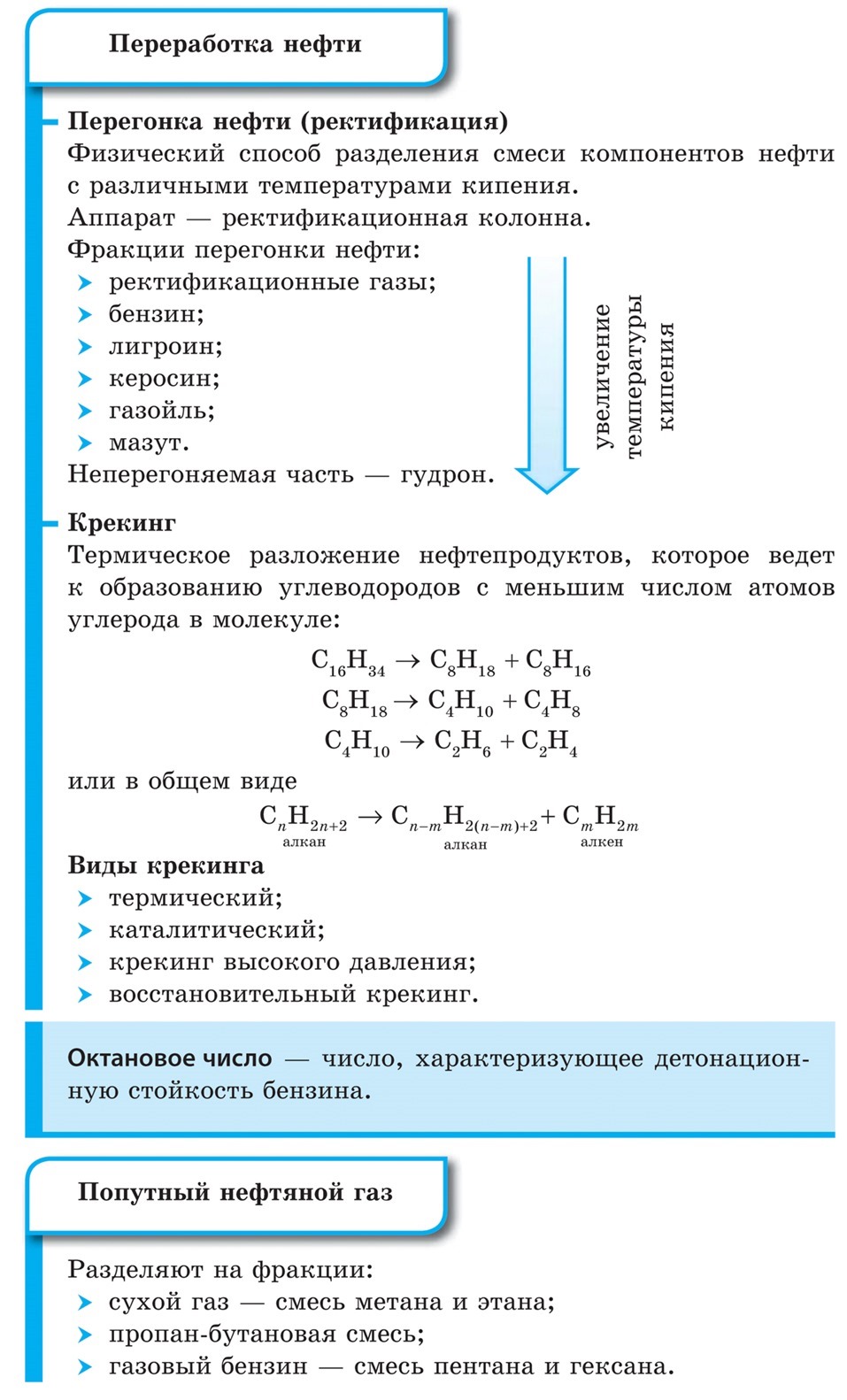
В природе нефть и попутный нефтяной газ заполняют полости земных недр. Представляя собой смесь различных веществ, нефть не имеет постоянной температуры кипения. Понятно, что каждый ее компонент сохраняет в смеси свои индивидуальные физические свойства, что и позволяет разделить нефть на составляющие. Для этого ее очищают от механических примесей, серосодержащих соединений и подвергают так называемой фракционной перегонке, или ректификации.
Фракционная перегонка — физический способ разделения смеси компонентов
Перегoнка осуществёяется в специальных установках – ректефикационных колонках в которых повторяют циклы в которых повторяют циклы конденсации и испарения жидких веществ, содержащихся в нефти.
Пары, образующиеся при кипении смеси веществ, обогащены более легкокипящим (т. е. имеющим более низкую температуру) компонентом. Это пары собирают, конденсируют (охлаждают до температуры ниже температуры кипения) и снова доводят до кипения. В этом случае образуются пары, еще более обогащенные легкокипящим веществом. Многократным повторением этих циклов можно добиться практически полного разделения веществ, содержащихся в смеси.
В ректификационную колонну поступает нефть, нагретая до температуры 320-350 °С. Ректификационная колонна имеет горизонтальные перегородки с отверстиями — так называемые тарелки, на которых происходит конденсация фракций нефти. На более высоких скапливаются легкокипящие фракции, на нижних — высококипящие.
В процессе ректификации нефть разделяют на следующие фракции:
• ректификационные газы — смесь низкомолекулярных углеводородов, преимущественно бутана и пропана с температурой кипения до 40 °С;
• газолиновую фракцию (бензин) — углеводороды состава от С5Н12 до С21Н24 (температура кипения 40-200 °С); при более тонком разделении этой фракции получают газолин (петролейный эфир, 40-70 °С) и бензин (70-120 °С);
• лигроиновую фракцию — углеводороды состава от С8Н18 до С14Н30 (температура кипения 150250 °С);
• керосиновую фракцию — углеводороды состава от С12Н26 до С18Н38 (температура кипения 180300 °С);
• дизельное топливо — углеводороды состава от С13Н28 до С19Н36 (температура кипения 200-350 °С).
Остаток перегонки нефти — мазут — содержит углеводороды с числом атомов углерода от 18 до 50. Перегонкой при пониженном давлении из мазута получают соляровое масло, смазочные масла, вазелин и парафин — легкоплавкие смеси твердых углеводородов. Твердый остаток перегонки мазута — гудрон — и продукты его переработки — битум и асфальт — используют для изготовления дорожных покрытий.
Крекинг
Полученные в результате ректификации нефти продукты подвергают химической переработке, включающей ряд сложных процессов. Один из них — крекинг нефтепродуктов. Мазут разделяют на компоненты при пониженном давлении, поскольку при атмосферном давлении его составляющие начинают разлагаться, не достигнув температуры кипения. Именно это и лежит в основе крекинга.
Крекинг — термическое разложение нефтепродуктов, приводящее к образованию углеводородов с меньшим числом атомов углерода в молекуле. Различают несколько видов крекинга: термический, каталитический, высокого давления, восстановительный.
Термический крекинг заключается в расщеплении молекул углеводородов с длинной углеродной цепью на более короткие под действием высокой температуры (470-550 °С). В процессе этого расщепления наряду с алканами образуются алкены:
В общем виде эту реакцию можно записать следующим образом:
Образовавшиеся углеводороды могут снова подвергаться крекингу с образованием алканов и алкенов с еще более короткой цепью атомов углерода в молекуле:
При обычном термическом крекинге образуется много низкомолекулярных газообразных углеводородов, которые можно использовать как сырье для получения спиртов, карбоновых кислот, высокомолекулярных соединений (например, полиэтилена).
Каталитический крекинг происходит при температуре 450 °С в присутствии катализаторов, в качестве которых используют природные алюмосиликаты состава nAl2O3 • mSiO2.
Осуществление крекинга с применением катализаторов приводит к образованию углеводородов, имеющих разветвленную или замкнутую цепь атомов углерода в молекуле. Содержание углеводородов такого строения в моторном топливе значительно повышает его качество, в первую очередь детонационную стойкость — октановое число бензина.
Крекинг нефтепродуктов протекает при высоких температурах, поэтому часто образуется нагар (сажа), загрязняющий поверхность катализатора, что резко снижает его активность.
Очистка поверхности катализатора от нагара — его регенерация — основное условие практического осуществления каталитического крекинга. Наиболее простым и дешевым способом регенерации катализатора является его обжиг, при котором происходит окисление нагара кислородом воздуха. Газообразные продукты окисления (в основном углекислый и сернистый газы) удаляются с поверхности катализатора.
Каталитический крекинг — гетерогенный процесс, в котором участвуют твердое (катализатор) и газообразные (пары углеводородов) вещества. Очевидно, что регенерация катализатора — взаимодействие твердого нагара с кислородом воздуха — также гетерогенный процесс.
Гетерогенные реакции (газ — твердое вещество) протекают быстрее при увеличении площади поверхности твердого вещества. Поэтому катализатор измельчают, а его регенерацию и крекинг углеводородов ведут в «кипящем слое», знакомом вам по производству серной кислоты.
Сырье для крекинга, например газойль, поступает в реактор конической формы. Нижняя часть реактора имеет меньший диаметр, поэтому скорость потока паров сырья очень высока. Движущийся с большой скоростью газ захватывает частицы катализатора и уносит их в верхнюю часть реактора, где из-за увеличения его диаметра скорость потока понижается. Под действием силы тяжести частицы катализатора падают в нижнюю, более узкую часть реактора, откуда вновь выносятся вверх.
Таким образом, каждая крупинка катализатора находится в постоянном движении и со всех сторон омывается газообразным реагентом.
Некоторые зерна катализатора попадают во внешнюю, более широкую часть реактора и, не встречая сопротивления потока газа, опускаются в нижнюю часть, где подхватываются потоком газа и уносятся в регенератор. Там также в режиме «кипящего слоя» происходит обжиг катализатора и возвращение его в реактор.
Таким образом, катализатор циркулирует между реактором и регенератором, а газообразные продукты крекинга и обжига удаляются из них.
Использование катализаторов крекинга позволяет несколько увеличить скорость реакции, уменьшить ее температуру, повысить качество продуктов крекинга.
Полученные углеводороды бензиновой фракции в основном имеют линейное строение, что приводит к невысокой детонационной устойчивости полученного бензина.
Отметим, что значительно большей детонационной стойкостью обладают углеводороды с молекулами разветвленного строения. Увеличить долю изомерных углеводородов разветвленного строения в смеси, образующейся при крекинге, можно, добавляя в систему катализаторы изомеризации.
Попутный нефтяной газ
Месторождения нефти содержат, как правило, большие скопления так называемого попутного нефтяного газа, который собирается над нефтью в земной коре и частично растворяется в ней под давлением вышележащих пород. Как и нефть, попутный нефтяной газ является ценным природным источником углеводородов. Он содержит в основном алканы, в молекулах которых от 1 до 6 атомов углерода. Очевидно, что по составу попутный нефтяной газ значительно беднее нефти. Однако, несмотря на это, он также широко используется и в качестве топлива, и в качестве сырья для химической промышленности. Еще несколько десятилетий назад попутный нефтяной газ сжигали как бесполезное приложение нефти. В настоящее время, например, в Сургуте, богатейшей нефтяной кладовой России, вырабатывают самую дешевую в мире электроэнергию, используя как топливо попутный нефтяной газ.
Как уже отмечалось, попутный нефтяной газ по сравнению с природным более богат по составу различными углеводородами. Разделяя их на фракции, получают:
• газовый бензин — легколетучую смесь, состоящую в основном из пентана и гексана;
• пропан-бутановую смесь, состоящую, как ясно из названия, из пропана и бутана и легко переходящую в жидкое состояние при повышенном давлении;
• сухой газ — смесь, содержащую в основном метан и этан.
Газовый бензин, являясь смесью летучих компонентов с небольшой молекулярной массой, испаряется даже при низких температурах. Это позволяет использовать газовый бензин в качестве топлива для двигателей внутреннего сгорания на Крайнем Севере и как добавку к моторному топливу, облегчающую запуск двигателя в зимних условиях.
Пропан-бутановая смесь в виде сжиженного газа применяется как бытовое топливо (газовые баллоны) и для заполнения зажигалок. Постепенный перевод автомобильного транспорта на сжиженный газ — один из основных путей преодоления глобального топливного кризиса и решения экологических проблем.
Сухой газ, близкий по составу к природному, также широко используется в качестве топлива.
Природный газ
Это смесь газообразных предельных углеводородов с небольшой молекулярной массой. Основным компонентом природного газа является метан, доля которого в зависимости от месторождения составляет от 75 до 99 % по объему. Кроме метана в состав природного газа входят этан, пропан, бутан и изобутан, а также азот и углекислый газ.
Как и попутный нефтяной, природный газ используется и как топливо, и в качестве сырья для получения разнообразных органических и неорганических веществ. Из метана — основного компонента природного газа — получают водород, ацетилен и метиловый спирт, формальдегид и муравьиную кислоту и многие другие органические вещества. В качестве топлива природный газ используют на электростанциях, в котельных системах водяного отопления жилых домов и производственных зданий, в доменном и мартеновском производствах. Чиркая спичкой и зажигая газ в кухонной газовой плите городского дома, вы «запускаете» цепную реакцию окисления алканов, входящих в состав природного газа.
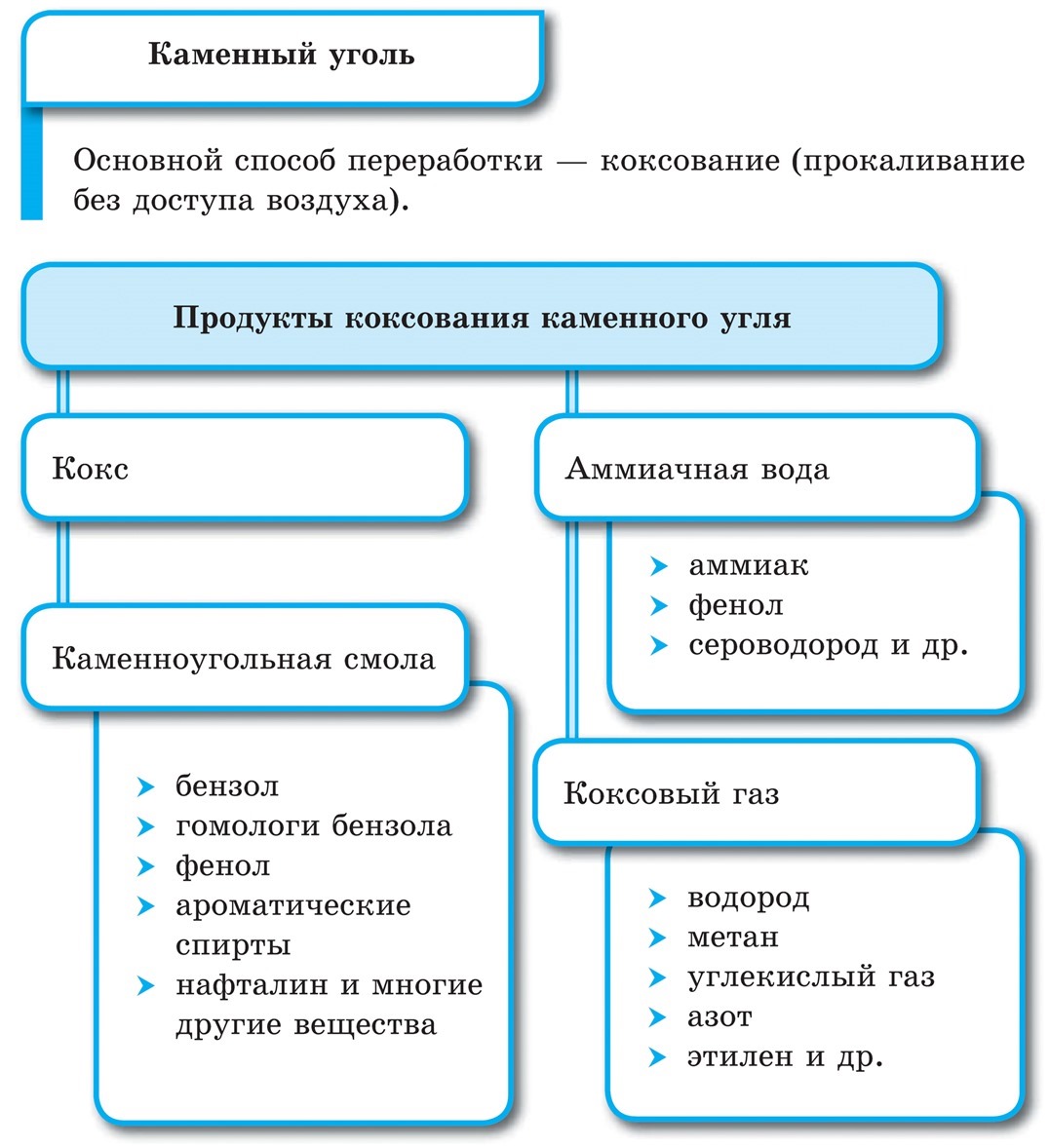
Каменный уголь
Кроме нефти, природного и попутного нефтяного газов, природным источником углеводородов является каменный уголь. Он образует мощные пласты в земных недрах, его разведанные запасы значительно превышают запасы нефти. Как и нефть, каменный уголь содержит большое количество различных органических веществ. Кроме органических, в его состав входят и неорганические вещества, такие, например, как вода, аммиак, сероводород и, конечно же, сам углерод — уголь. Одним из основных способов переработки каменного угля является коксование — прокаливание без доступа воздуха. В результате коксования, которое проводят при температуре около 1000 °С, образуются:
• коксовый газ, в состав которого входят водород, метан, угарный и углекислый газы, примеси аммиака, азота и других газов;
• каменноугольная смола, содержащая несколько сотен различных органических веществ, в том числе бензол и его гомологи, фенол и ароматические спирты, нафталин и различные гетероциклические соединения;
• надсмольная, или аммиачная вода, содержащая растворенный аммиак, а также фенол, сероводород и другие вещества;
• кокс — твердый остаток коксования, практически чистый углерод.
Кокс используется в производстве чугуна и стали, аммиак — в производстве азотных и комбинированных удобрений, а значение органических продуктов коксования трудно переоценить.
Таким образом, попутный нефтяной и природный газы, каменный уголь — не только ценнейшие источники углеводородов, но и часть уникальной кладовой невосполнимых природных ресурсов, бережное и разумное использование которых — необходимое условие прогрессивного развития человеческого общества.
Производство серной кислоты. Контактный способ.
Исходным сырьём для производства серной кислоты могут быть сера, сероводород, сульфиды металлов.
Рассмотрим производство серной кислоты контактным способом, при котором исходным сырьём является пирит FeS2
Процесс состоит из трех стадий:
1. Обжиг пирита, Получение оксида серы (II). Очистка печного газа. Уравнение реакции первой стадии:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 8000С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
Очистка печного газа. Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2.
2. Окисление SO2 в SO3 кислородом. Протекает в контактном аппарате.
Уравнение реакции этой стадии:
2SO2 + O2 = 2SO3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
а) температура:
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-5000С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия(V) V2O5.
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-5000С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
3. Получение H2SO4
Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде:
SO3 + H2O = H2SO4
Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Уравнение реакции этого процесса:
nSO3 + H2SO4 = H2SO4·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Нитрозный способ
При нитрозном способе получения серной кислоты окисление сернистого газа осуществляется оксидами азота. Обжиговый газ подается в продукционную башню, орошаемую нитрозилсерной кислотой (NОНSО3). Для запуска процесса сернистую кислоту окисляют азотной кислотой согласно уравнениям:
SО2 + Н2О = Н2SО3;
3Н2SO3 + 2НNО3 = 3Н2SО4 + 2NО + Н2О
Оксиды азота вместе с выхлопными газами (азот и кислород) подаются в следующую башню для окисления монооксида азота в диоксид. Поток газа регулируют таким образом, чтобы 50 % газа проходило через окислительную башню, а 50 % — миновало ее. Таким образом в поглотительную башню попадает газовая смесь, содержащая монооксид и диоксид азота в эквимолярном соотношении, вследствие чего образуется азотистый ангидрид:
NО + NО2 = N2О3
При низкой температуре равновесие сдвигается в сторону образования азотистого ангидрида (N2О3), а при повышении температуры — в сторону образования монооксида и диоксида азота. В поглотительной башне азотистый ангидрид реагирует с концентрированной серной кислотой, образуя нитрозилсерную кислоту:
N2О3 + 2Н2SO4 = 2NОНSО4 + Н2О
Эта реакция может протекать только с концентрированной серной кислотой. При разбавлении водой нитрозилсерная кислота вновь разлагается на серную кислоту и оксиды азота.
Нитрозилсерная кислота подается на орошение в продукционную башню, где и разлагается водой, а выделившийся азотистый ангидрид окисляет образующуюся в башне сернистую кислоту:
2NОНSO4 + Н2О = 2Н2SO4 + N2О3;
SO2 + Н2О = Н2SO3;
Н2SО3 + N2О3 = Н2SO4 + 2NО.
Монооксид азота вновь направляется в окислительную башню и процесс повторяется.
Оксиды азота, которые не поглотились серной кислотой, улавливаются в санитарной башне, в которую подают либо раствор соды (Nа2СО3), либо раствор извести (Са(ОН)2):
N2О3 + Nа2СО3 = 2NаNО2 + СО2;
2NО2 + Nа2СО3 = NаNО3 + NаNО2 + СО2;
N2О3 + Са(ОН)2 = Са(NО3)2 + Н2О;
4NО2 + 2 Са(ОН)2 = Са(NО3)2 + Са(NО2)2 + 2Н2О.
Потеря оксидов азота компенсируется введением новых порций азотной кислоты.
Концентрация серной кислоты, получаемой нитрозным способом, достигает 70-80 %.
Шпаргалка
Справочный материал для прохождения тестирования:



























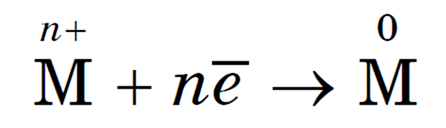
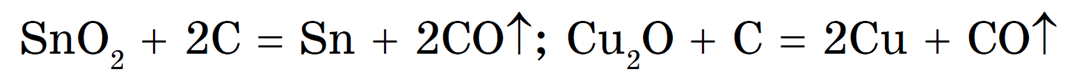
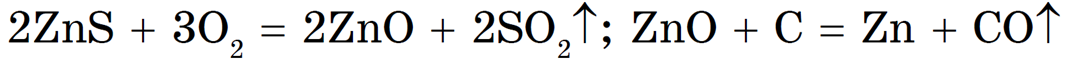
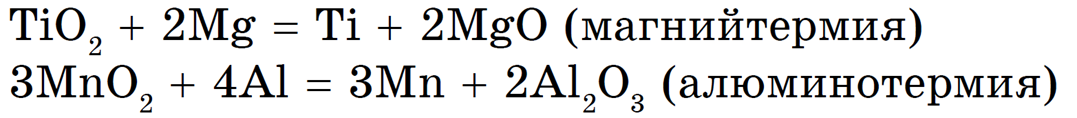
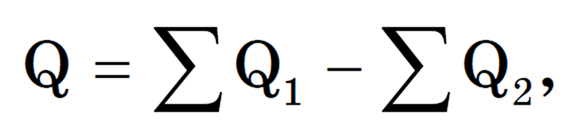
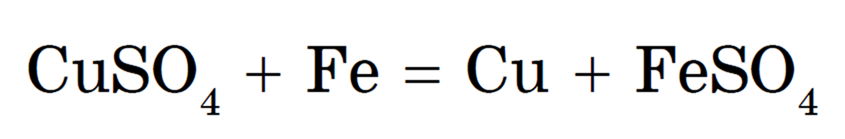
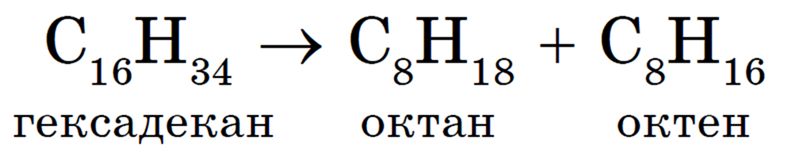
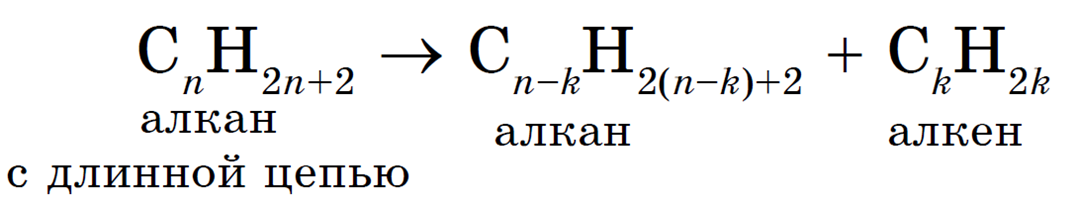
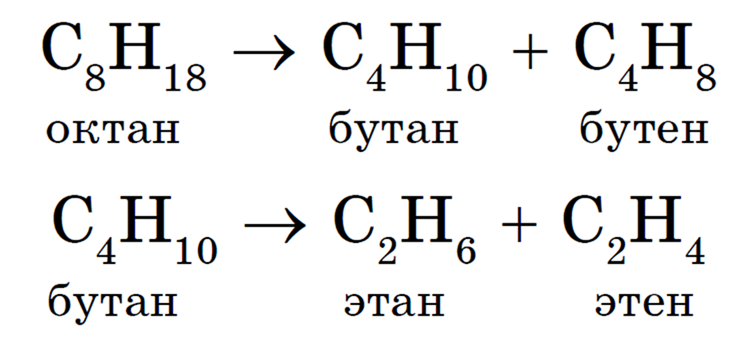












в разделе «производство серной кислоты» 1 этап — получение оксида серы 4, а не 2!