Характерные химические свойства: альдегидов, кетонов и предельных карбоновых кислот
Оглавление
- Строение альдегидов и кетонов
- Номенклатура и изомерия альдегидов и кетонов
- Физические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- Отдельные представители альдегидов и их значение
- Строение карбоновых кислот
- Номенклатура и изомерия карбоновых кислот
- Физические свойства карбоновых кислот
- Химические свойства карбоновых кислот
- Отдельные представители карбоновых кислот и их значение
- Шпаргалка
- Задания для самопроверки
Строение альдегидов и кетонов
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу:
соединенную с атомом водорода и углеводородным радикалом. Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде роль углеводородного радикала играет другой атом водорода:

Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:
Кетоны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кето-группой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода с молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи).
Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Физические свойства альдегидов и кетонов
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь С=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей.
Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
1. Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2.
2. Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
1. Окисление кислородом воздуха. Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:
2. Окисление слабыми окислителями (аммиачный раствор оксида серебра). В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Окисление свежеосажденным гидроксидом меди (II). Окисляя альдегид, Cu2+ восстанавливается до Cu+. Образующийся в ходе реакции гидроксид меди (I) CuOH сразу разлагается на оксид меди (I) красного цвета и воду.
Эта реакция, так же как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид HCHO) — бесцветный газ с резким запахом и температурой кипения -21 °С, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде (40 %) называют формалином и применяют для формальдегид и уксусной дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид CH3CHO) — жидкость с резким, неприятным запахом и температурой кипения 21 °С, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Строение карбоновых кислот
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов —
— называется карбоксильной группой, или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот RCOOH, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат π-связей в углеводородном радикале.
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой)
СН2=СН—СООН
или олеиновой
СН3—(СН2)7—СН=СН—(СН2)7—СООН
и других кислот.
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия карбоновых кислот
Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов—, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Состав предельных одноосновных карбоновых кислот будет выражаться общей формулой СnН2nO2, или СnН2n+1СOOН, или RСООН.
Физические свойства карбоновых кислот
Низшие кислоты, т. е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (например, запах уксусной кислоты). Кислоты, содержащие от 4 до 9 атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода в молекуле — твердые вещества, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, температура кипения муравьиной кислоты равна 100,8 °С, уксусной — 118 °С, пропионовой — 141 °С.
Простейшая карбоновая кислота — муравьиная НСООН, имея небольшую относительную молекулярную массу (Мr(НСООН) = 46), при обычных уcловиях является жидкостью с температурой кипения 100,8 °С. В то же время бутан (Mr(C4H10) = 58) в тех же условиях газообразен и имеет температуру кипения -0,5 °С. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил
— и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства карбоновых кислот
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
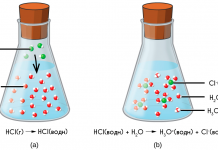
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т. е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода:
Так, железо восстанавливает водород из уксусной кислоты:
3. Взаимодействие с основными оксидами с образованием соли и воды:
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т. е. вступать в реакцию этерификации, могут и многоатомные спирты, например, глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну л-связь, можно записать уравнение в общем виде:
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота HCOOH — жидкость с резким запахом и температурой кипения 100,8 °C, хорошо растворима в воде.
Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту.
Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленностях, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота CH3COOH — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых отношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса (3-5 % -й раствор) и уксусной эссенции (70-80 %-й раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды. Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая C15H31COOH и стеариновая C17H35COOH кислоты. В отличие от низших кислот эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах.
Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота C17H33COOH, или CH3 — (CH2)7 — CH = CH —(CH2)7COOH. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота HOOC—COOH, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленностях.
Шпаргалка
Справочный материал для прохождения тестирования:














































![clip_image025[6] clip_image025[6]](/wp-content/uploads/2017/04/clip_image0256_thumb.jpg)

![clip_image028[6] clip_image028[6]](/wp-content/uploads/2017/04/clip_image0286_thumb.png)
![clip_image029[6] clip_image029[6]](/wp-content/uploads/2017/04/clip_image0296_thumb.png)
![clip_image030[6] clip_image030[6]](/wp-content/uploads/2017/04/clip_image0306_thumb.png)
![clip_image031[6] clip_image031[6]](/wp-content/uploads/2017/04/clip_image0316_thumb.png)
![clip_image032[6] clip_image032[6]](/wp-content/uploads/2017/04/clip_image0326_thumb.png)
![clip_image033[6] clip_image033[6]](/wp-content/uploads/2017/04/clip_image0336_thumb.png)

![clip_image036[6]_thumb clip_image036[6]_thumb](/wp-content/uploads/2017/04/clip_image0366_thumb_thumb.png)
![clip_image037[6]_thumb clip_image037[6]_thumb](/wp-content/uploads/2017/04/clip_image0376_thumb_thumb.png)
![clip_image039[6]_thumb clip_image039[6]_thumb](/wp-content/uploads/2017/04/clip_image0396_thumb_thumb.png)
![clip_image040[6]_thumb clip_image040[6]_thumb](/wp-content/uploads/2017/04/clip_image0406_thumb_thumb.png)
![clip_image041[6]_thumb clip_image041[6]_thumb](/wp-content/uploads/2017/04/clip_image0416_thumb_thumb.png)
![clip_image042[6]_thumb clip_image042[6]_thumb](/wp-content/uploads/2017/04/clip_image0426_thumb_thumb.png)
![clip_image043[6]_thumb clip_image043[6]_thumb](/wp-content/uploads/2017/04/clip_image0436_thumb_thumb.png)
![clip_image044[6]_thumb clip_image044[6]_thumb](/wp-content/uploads/2017/04/clip_image0446_thumb_thumb.png)
![clip_image045[6]_thumb clip_image045[6]_thumb](/wp-content/uploads/2017/04/clip_image0456_thumb_thumb.png)
![clip_image046[6]_thumb clip_image046[6]_thumb](/wp-content/uploads/2017/04/clip_image0466_thumb_thumb.png)
![clip_image047[6]_thumb clip_image047[6]_thumb](/wp-content/uploads/2017/04/clip_image0476_thumb_thumb.png)
![clip_image048[6]_thumb clip_image048[6]_thumb](/wp-content/uploads/2017/04/clip_image0486_thumb_thumb.png)
![clip_image049[6]_thumb clip_image049[6]_thumb](/wp-content/uploads/2017/04/clip_image0496_thumb_thumb.png)
![clip_image050[6]_thumb clip_image050[6]_thumb](/wp-content/uploads/2017/04/clip_image0506_thumb_thumb.png)
![clip_image051[6]_thumb clip_image051[6]_thumb](/wp-content/uploads/2017/04/clip_image0516_thumb_thumb.png)
![clip_image052[6]_thumb clip_image052[6]_thumb](/wp-content/uploads/2017/04/clip_image0526_thumb_thumb.png)
![clip_image053[6]_thumb clip_image053[6]_thumb](/wp-content/uploads/2017/04/clip_image0536_thumb_thumb.png)
![clip_image054[6]_thumb clip_image054[6]_thumb](/wp-content/uploads/2017/04/clip_image0546_thumb_thumb.png)
![clip_image055[6]_thumb clip_image055[6]_thumb](/wp-content/uploads/2017/04/clip_image0556_thumb_thumb.png)











Страшно представить сколько усилий надо приложить, чтобы так качественно наполнить сайт такой тематики.
Вроде и тема не сложная, но аспектов довольно много, повторить нужно будет обязательно.