История атома: теории и модели
Вся материя состоит из атомов. Это то, что мы теперь представляем, как само собой разумеющееся, и одна из первых вещей, которую вы узнаете сразу в начале своего обучения химии. Несмотря на это, наши представления о том, что же такое атом появилось совсем недавно: всего за сто лет назад, причем ученые до сих пор спорят, как именно атом выглядит.
Графическое представление модели атома было предложено в 1800-х годах, но идея «атома» существовала задолго до того. Слово «атом» происходит от древнегреческого «ἄτομος» и примерно переводится как «неделимый». Древнегреческая теория чаще всего приписывается Демокриту (460-370 до н.э.) и его наставнику Левкиппу. Хотя их идеи об атомах были рудиментарными по сравнению с нынешней концепцией сегодня, они обрисовал важную идею, состоящую в том, что все состоит из атомов — невидимых и неделимых сфер материи бесконечного типа и числа.
![clip_image001[6] clip_image001[6]](/wp-content/uploads/2017/03/clip_image0016.jpg)
Древнегреческие философы предположили, что атомы отличаются своей формой в зависимости от типа. Например, атомы железа представлялись виде крючков, которые цеплялись друг за друга, что объясняло почему железо было твердым при комнатной температуре, а атомы воды были гладкими и скользкими, поэтому вода была жидкой при комнатной температуре. И хоть теперь мы знаем, что это не так, их идеи были заложены в основу будущих атомных моделей.
Новое представление об атоме появилось лишь в 1803 году, когда английский химик Джон Дальтон начал развивать научное определение атома. Он основывался на идеи древних греков в описании атомов как маленьких, твердых, неделимых сфер, как и у греческих философов, у Дальтона атомы одного элемента идентичны друг другу. Последний пункт по-прежнему является в значительной степени верным, исключением являются изотопы различных элементов, которые отличаются по числу нейтронов. Однако, так как нейтрон не был обнаружен до 1932 года, мы, вероятно, можем простить Дальтону эту ошибку. Дальтон также придумал теорию о том, как атомы объединяются, образуя соединения, а также представил первый набор химических символов для известных элементов.
![clip_image002[4] clip_image002[4]](/wp-content/uploads/2017/03/clip_image0024.jpg)
![clip_image003[4] clip_image003[4]](/wp-content/uploads/2017/03/clip_image0034.png)
Представление атомной теории Дальтона было началом развития современной модели атома. Однако затем последовал еще один период где наши знания об атоме никак не прогрессировала. Конечно существовали попытки понять, как атомы могут выглядеть, например, такими попытками являлись например предположения лорда Кельвина, что атомы — это вихревые частицы, вращение которых объясняет их основные свойства, по аналогии с теорией гидродинамических вихрей.
Первый прорыв произошел в конце 1800-х годов, когда английский физик Джозеф Джон Томсон обнаружил, что атом не был столь же неделимым, как заявлялось ранее. Он проводил эксперименты с использованием катодных лучей (электронных пучков), произведенных в разрядной трубке, и обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкивается отрицательно заряженными. Из этого он сделал вывод, что лучи должны быть заряжены отрицательно.
![clip_image004[6] clip_image004[6]](/wp-content/uploads/2017/03/clip_image0046.jpg)
![clip_image005[4] clip_image005[4]](/wp-content/uploads/2017/03/clip_image0054.png)
Изучая частицы в лучах, он смог сделать вывод о том, что они были в две тысячи раз легче, чем водород, а также путем изменения металла катода, он продемонстрировал, что эти частицы присутствовали во многих типах атомов. Таким образом он открыл электрон (хотя он называл его как «корпускул»), и показал, что атомы не являются неделимыми. За это открытие он получил Нобелевскую премию в 1906 году.
В 1904 году он выдвинул свою модель атома на основе своих выводов, названную «пудинговой моделью атома». Данная модель представляла атом как положительно заряженную сферу, с электронами, усеянными в сфере, как сливы в пудинге. Модель Томсона была вскоре опровергнута его учеником.
Эрнест Резерфорд являлся физиком из Новой Зеландии, обучался в Кембриджском университете у Томсона. Работая в Университете Манчестера, он представил новое представление о модели атома. Его работа была опубликована уже после того, как он получил Нобелевскую премию в 1908 году за исследования в химии радиоактивных веществ.
![clip_image006[4] clip_image006[4]](/wp-content/uploads/2017/03/clip_image0064.jpg)
![clip_image007[4] clip_image007[4]](/wp-content/uploads/2017/03/clip_image0074.png)
Резерфорд разработал эксперимент, который помог исследовать атомную структуру. Для этого он стрелял положительно заряженными альфа-частицами в тонкий лист золотой фольги. Альфа-частицы были настолько малы, что проходили сквозь золотую фольгу. В соответствии с моделью Томсона, в которой положительный заряд диффундирует по всему атому, альфа частицы должны были пройти насквозь листа практически без отклонения. Проводя этот эксперимент, Резерфорд надеялся, подтвердить модель Томсона — своего учителя, однако, все оказалось как раз наоборот.
В ходе эксперимента, большинство из альфа-частиц, проходили через фольгу практически без отклонения. Тем не менее, очень небольшое число частиц отклонялись от намеченного пути, отклоняясь при этом на очень большой угол. Это было совершенно неожиданно; как заметил сам Резерфорд, «Это было почти так же невероятно, как если бы вы выпустили 15-дюймовый снаряд в папиросную бумагу, а он вернулся бы и ударил бы тебя». Единственным возможным объяснением было то, что положительный заряд не распространялся по всему атому, а был локализован в небольшом, плотном центре — ядре. Согласно этому, большой частью остальной части атома являлось просто пустое пространство.
Открытие Резерфордом ядра означало необходимость переосмысления атомной модели. Он предложил модель, в которой электроны вращаются вокруг положительно заряженного ядра. Однако, он не объяснил, что держит электроны, вращающиеся вокруг ядра вместо того, чтобы просто упасть на ядро.
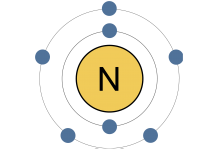
Новая модель была представлена Нильсом Бором. Бор был датским физик, который приступил к решению проблем, связанных с моделью Резерфорда. Так как, классическая физика не могла правильно объяснить, что происходит на атомном уровне, он обратился к квантовой теории для объяснения расположение электронов. Его модель постулировала существование энергетических уровней или электронных оболочек. Электроны могут находится только на этих энергетических уровнях; Другими словами, их энергия квантуется, и не может принять только какое-либо значение между квантованными уровнями. Электроны могут перемещаться между этими энергетическими уровнями (именуемыми Бором как «стационарные состояния»), но при условии поглощения или испускания энергии.
![clip_image008[4] clip_image008[4]](/wp-content/uploads/2017/03/clip_image0084.jpg)
![clip_image009[4] clip_image009[4]](/wp-content/uploads/2017/03/clip_image0094.png)
Предложение Бором стабильных энергетических уровней в некоторой степени решала проблему падения электронов по спирали на ядро. Истинные причины сложнее, и они скрыты в сложном мире квантовой механики; и, как Бор сам сказал: «Если квантовая механика вас не потрясла до глубины души, то вы просто еще этого поняли (или вы еще недостаточно хорошо понимаете квантовую механику — игра слов, прим. переводчика)».
Модель Бора не решает всех проблем атомной модели. Она хорошо подходит для атомов водорода, но не может объяснить наблюдения за более тяжелыми элементами. Это также нарушает принцип неопределенности Гейзенберга, один из краеугольных камней квантовой механики, в которой говорится, что мы не можем знать точное местоположение и импульс электрона одновременно. Тем не менее, модель атома Бора наиболее широко распространена и известна, что связано с удобством объяснения химической связи и реакционной способности некоторых групп элементов на начальном этапе обучения.
Во всяком случае, модель все еще требует переработки. На данный момент, многие ученые проводили исследования и пытаясь разработать квантовую модель атома. Главным среди них являлся австрийский физик Эрвин Шредингер, которого вы, вероятно, знаете благодаря «Коту Шредингера». В 1926 Шредингер предположил, что, электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
![clip_image010[6] clip_image010[6]](/wp-content/uploads/2017/03/clip_image0106.jpg)
![clip_image011[4] clip_image011[4]](/wp-content/uploads/2017/03/clip_image0114.png)
Шредингер решил ряд математических уравнений для описания модели распределения электрона в атоме. Его модель демонстрирует ядро, окруженное облаками электронной плотности. Эти облака являются облаками вероятности; хотя мы не знаем точно где электроны в тот или иной момент времени, но мы знаем в каких заданных областях пространства они вероятно могут находится. Эти участки пространства называются электронными орбитами. Становится понятно, почему в средней школе уроки химии зачастую не приводят эту модель, хотя это модель считается наиболее точной!
Уже после Шредингера, в 1932 году английский физик Джеймс Чедвик (ученик Эрнеста Резерфорда) обнаружил существование нейтрона, завершая нашу картину субатомных частиц, составляющих атом. Однако, история не заканчивается на этом; физики обнаружили, что протоны и нейтроны, составляющие ядро, сами делится на частицы, называемые кварками — но это уже совсем другая история! Во всяком случае, модель атома дает нам отличный пример того, как научные модели могут меняться с течением времени, и показывает, как новые данные могут привести к появлению новых моделей.

































Здорово! А я думала, что совсем уже все забыла по истории химии. Ан нет, еще кое-что помню. Спасибо за очень интересную статью!
Теории великих учёных прошлых столетий, лучшие умы человечества. Если взять во внимание, что модель атома кардинально изменилась за последние двести лет, и зная сегодняшние технологии и темпы развития, даже не возможно представить, что же будет через сто лет от нынешнего времени.
при всем моем глубоком уважении к схемам и графическому решению атома, нам нужно отучаться от этих «шариков», пронизанных «палочками» и не мыслить образами, когда дело касается таких малоизученных вещей. Визуализация хороша на первых порах, дальше — нужно отходить от Земного, иначе в попытке понять устройства мира мы будем мыслить не выше собственной головы.
Все таки первая модель созданная Томсоном стала основой для развития уже других моделей атома. Кстати, интересно, что называли «пудинговой моделью атома». Так проще запомнить школьнику.
Хорошо что нашла этот сайт, как раз готовлю доклад по теории атомов, здесь интересный материал, от теории древнегреческих философов до исследований Шредингера. Особенно интересно было узнать об эксперименте Резерфорда с золотой фольгой.