Алкины
Оглавление
- Строение алкинов
- Гомологический ряд этина
- Изомерия и номенклатура алкинов
- Физические свойства алкинов
- Химические свойства алкинов
- Шпаргалка
- Задания для самопроверки
Строение алкинов
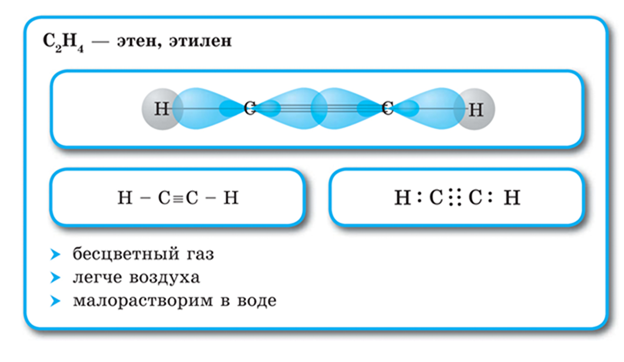
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СnН2n-2.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sp-гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π-связи. Таким образом, тройная связь состоит из одной σ-связи и двух π-связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости π-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Тройная связь — это комбинация одной s- и двух p-связей. Атомы углерода, входящие в состав молекулы ацетилена, находятся в состоянии sp-гибридизации.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура алкинов
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу C6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства алкинов
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома).
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях гидрогалогенирования выполняется правило Марковникова:
3. Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt, Pd, Ni):
Так как тройная связь содержит две реакционноспособные π-связи, алканы присоединяют водород в две ступени:
1) тримеризация — начальный этап, в течение которого при пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация — следующий этап, в процессе которого под действием солей одновалентной меди образуется винилацетилен:
Это вещество используется для получения хлоропрена:
полимеризацией которого получают хлоропреновый каучук:
Окисление алкинов. Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
На этой реакции основано действие кислородноацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °с), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т. к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Шпаргалка
Справочный материал для прохождения тестирования:



















































Очень полезная статья! Написано хорошо, поэтому читается интересно, тем более эта хорошая подготовка к контрольной!
В какой части задании это будет на экзамене? Дочь еще в 10, и с такими формулами она пока не дружит.
Задания на характерные свойства алкинов встречаются и в части 1 и в части 2!
Успехов в обучении! Ваш Администратор!
У меня в школе была четверка по химии. Но я ничего не помню про алкины. Даже не знаю, изучали мы их или нет.